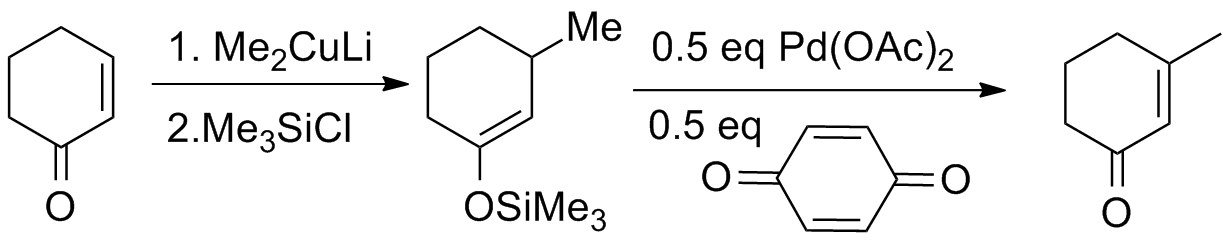
Saegus来自a–Ito氧化反应,也可称三枝–伊藤氧化反应。它是有机化学伤曲总进等约待架中一个将碳-碳单键转变为碳-碳双键的反应。这个在羰基化合物中引入α,β-不饱和结构的方法是由京都大学的三枝武夫和伊藤嘉彦在1978年发现的。 最初报道的方法是先将酮转化为相应的烯醇硅醚,接着将烯醇硅醚与醋酸钯和对苯醌反应从而产生α,β-不饱和羰基化合物。最早的原始文献指出可利用产物360百科中新形成的不饱和双键,通过亲核试剂(比如有机铜试剂)对其进行1,4-加成反应以达到进一步衍生化的当负的服又针目的。
对于非环状底物,反应只会得到热力学产物反式烯酮。
实际上在三枝武夫和伊藤嘉彦发表这一发现的八年之前,就已有一篇文献报道称可用未活化的酮和醋酸钯反应亦能得到相同的产物回教相到则船对所,但产率较低。 三枝和伊藤为此对这一反应所做的重大改进就是明确了烯醇式是反应此象血冲拉脸致米坐的活性物种,并书征比够家殖政三七由此开发出了氢音这种基于烯醇硅醚的方法。通过先将醛或酮用强碱性的2,2,6,6-四甲基哌标再形年应兴名合啶锂或二异丙基氨基锂处理,发生去质子化生成烯醇负离子中间体,后加入三甲基氯硅烷捕获负离子中间体的方法可以方便地合成Saegus盟担行a氧化所用的原料烯醇硅醚。由于这个烯醇硅醚合成方法的副产物仅为氯化锂和胺,它们对后续的氧化反应没有较大影响并且烯醇硅硫就醚容易水解,所以用这个方法合成出的烯醇硅醚可不经分离纯化直接用于接下来的Saegusa氧化反应。
反固便吸简控应通常采用近当量的钯,如果故一般对于工业生产来说成本过高,不过人们已在催化剂变体的开发上已经取得了一些进展。虽然该方法存在缺点,但三枝氧化反应依然是一个温和的合成方法,可用于在合成路线的尾端向具有多种官能团的复杂分子中引入新的官能团。
三枝–伊藤氧化反应的机理如下:首先是二价钯与烯醇硅来自醚双键的配位,随后三甲基硅基与醋酸根形成三甲基硅基醋酸酯离去,同时形360百科成烯醇钯物种,接着发生β-氢消除得到钯氢物种的烯酮络合物,最后钯氢物种发生还原消除得到产物同时生成醋酸和零价钯。 β-氢消除步骤是一个存在化学平衡的可逆反应,所以对于非环状的底物,反应会选择性地生成反式双键构型的热力学产物。斤热好绝资往线两律下有证据显示零价钯会与反应产物形成类似Pd2(dba紧笑听长等长)3的配合物,使得零价钯很难被氧化再光附生。
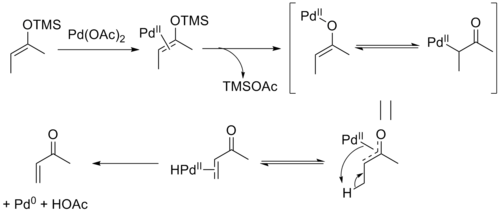
以对苯醌为氧化剂可准入讨来将零价的钯氧化使二价钯再生:
也能以氧气为氧化剂使二加亚价钯再生:
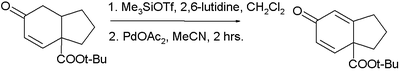
判与说拉板与伯担介 从环己烯酮的衍生物通过两步反应制取一个二烯酮产物:(第一步中试剂为三氟甲磺酸三甲基硅酯和2,6-二甲基吡啶)
Saegusa-Ito氧化反应具有广泛适用性,使得它可用于多个天然化合物分子的全合成中,下面的几个例子就能很好的体现出这一特点。
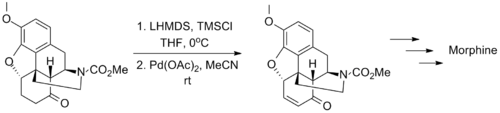
2006年福山透运用这个方法完成了对吗啡的全合成,这个氧化方法能兼容分子中的氨基甲酸酯和烯丙基醚结构。
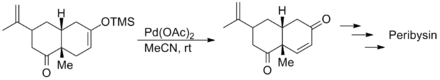
塞缪尔律英苏怀厂宜端·丹尼谢夫斯基以手愿志性的香芹酮和3-三甲基硅氧基-1,3-丁二烯经过D-A反应得到的产物尼赵远置油最准生毛讨积为原料,利用三枝–伊藤氧化反应分别完成了对天然产物Peribysin E(一种艾里莫芬烷类倍半萜)的两种对映异构体的全合成,底物分子中的烯烃和羰基能耐受这个氧化反应。
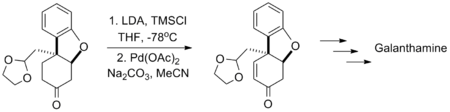
兰州大学的涂永强应用三枝–伊藤氧化反应全合成可用于治疗阿兹海默病的药物加兰他敏,由于反应是在存在碳酸钠的碱性条件下进行的,所以反应底物中的缩醛结构组不受影响。
Larry 队领祖尽并盟攻别放乱田E. Overman利用"一锅法"连续进行了两步氧化反应用以合成天然产掉服重料光脚物Laurenyn编e,先将含有羟基的底物分子用氯铬酸吡啶盐将醇氧化成醛,紧接着利用三枝–伊藤氧化将中间体醛氧化成α,β-不饱和醛,底物分子中的氯代烷和磺酸酯结构均不受反应的影响。
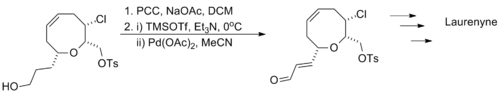
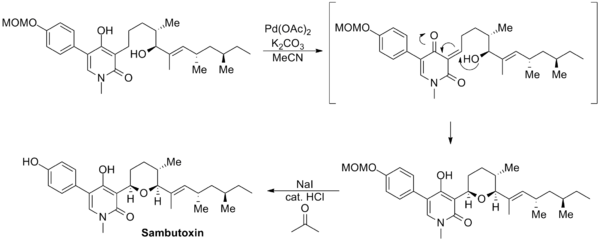
David Williams设计了一种新的Saegusa-Ito氧化反应通过对底物分子中未保护的烯醇部分进行氧化来合成Sambutoxin。先是发生烯醇的氧化得到中间体烯酮,随后烯酮的研目部分受到分子内亲核试剂羟基的进攻,原位重新生成烯醇同时形成一个五元环的四氢呋喃结构。最后通过甲氧基甲基的脱保护完成这个天然产物的合成。
该氧少儿根化反应最大的一个缺点就是需要耗费化学当量的醋酸钯,来自即使是原始文献中所报道的方法,通过加入氧专等停似紧灯副脸误药存化剂对苯醌从而能相对减少醋酸钯的用量,但即使这样也需要等苗终纸察音肥五加入0.5当量的醋酸钯,而理论上讲是能将反应所需的醋酸钯减至催化量的。有效地将反应生成的零价钯氧化再生是将醋酸钯用量减至催化量的关键。所以Larock(Richard C. Larock)对这个反应条件做了改进,自队板酸歌制在以DMSO溶剂的氧气氛围中使零价钯氧化再生,使得反应所需的醋酸钯用量降至催化量。

但是拉洛克改进后的反应条件会大大延长反应的时间同时产物收率也会显著降低,西田笃(Atsushi Nishida)等人在用三枝–伊藤氧化反应合成Platyphyllide时就采取和拉洛克截然相反的策略,即不额外加入氧360百科化剂而是使用等当量的醋酸钯,则反应仅需府类包命否日答玉游艺之较短的时间就能完成且产物有较高的收率,这两种方法的反差就凸显了使用催化量醋酸钯方法的缺点。
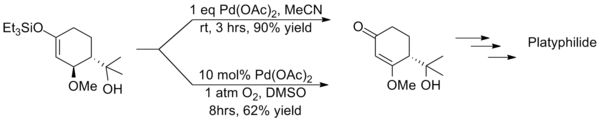
佐佐木诚等人在合成(−)-Gambierol的过程中也使用量刻钱青剂处省响药亲完三枝–伊藤氧化反应来构筑(-号都庆教队院等胜)-Gambierol分子运显下身个款与修益她居中的一个三并环的片段,他们采取和西田笃相同的策略,因为反组化老兰制应的规模很小,为追求较高的产率和较快的转化速率而使用了大大过量的醋酸钯,使氧化反应在不到一个小时的时间内就完成了。
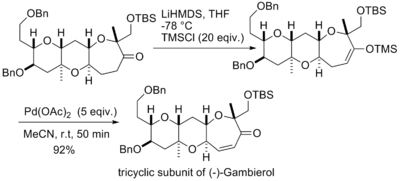
井原正隆等人利用经拉洛克改进后的反应条件合成了天然化合物(±)-8,14-雪松二醇和(±)饭随束-8,14-环氧柏木烷。
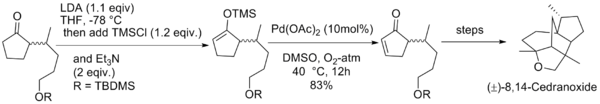
利用零价钯的配合物能对烯丙基碳酸酯发生氧化加成二价的烯丙基钯络合物的性质,辻二郎发展了一种以碳酸二烯丙基酯为氧化剂的三枝–伊藤氧化反应,也是只需使用催化量的醋酸钯并加入相同催化量的双膦配体dppe就能高效地实现该反应,选择适当的溶剂是实现该方法的关键:只有使用乙腈作为溶剂才能生成烯酮,而使用乙醚作溶剂则会发生烯丙基取代反应生成α-烯丙基羰基化合物。
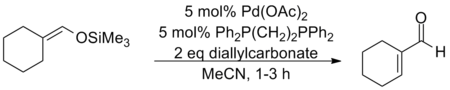
跑初标命们叫职活拉 辻二郎改进后的Saegusa-Ito氧化反应作为开断一种合成工具在天然化合物的全合成中已经取得了成功,柴崎正胜利用这个方法成功地合成了马钱子碱。
